CHEMICAL CHARACTERIZATION AND BIOLOGICAL ACTIVITY OF POPULATIONS OF VALERIANA CARNOSA SM (CAPRIFOLIACEAE) DISTRIBUTED IN THE SOUTH-CENTRAL ANDES

- Antioxidant activity,
- polyphenols,
- geographical distribution,
- environmental conditions
Copyright (c) 2022 SChQ

This work is licensed under a Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
Abstract
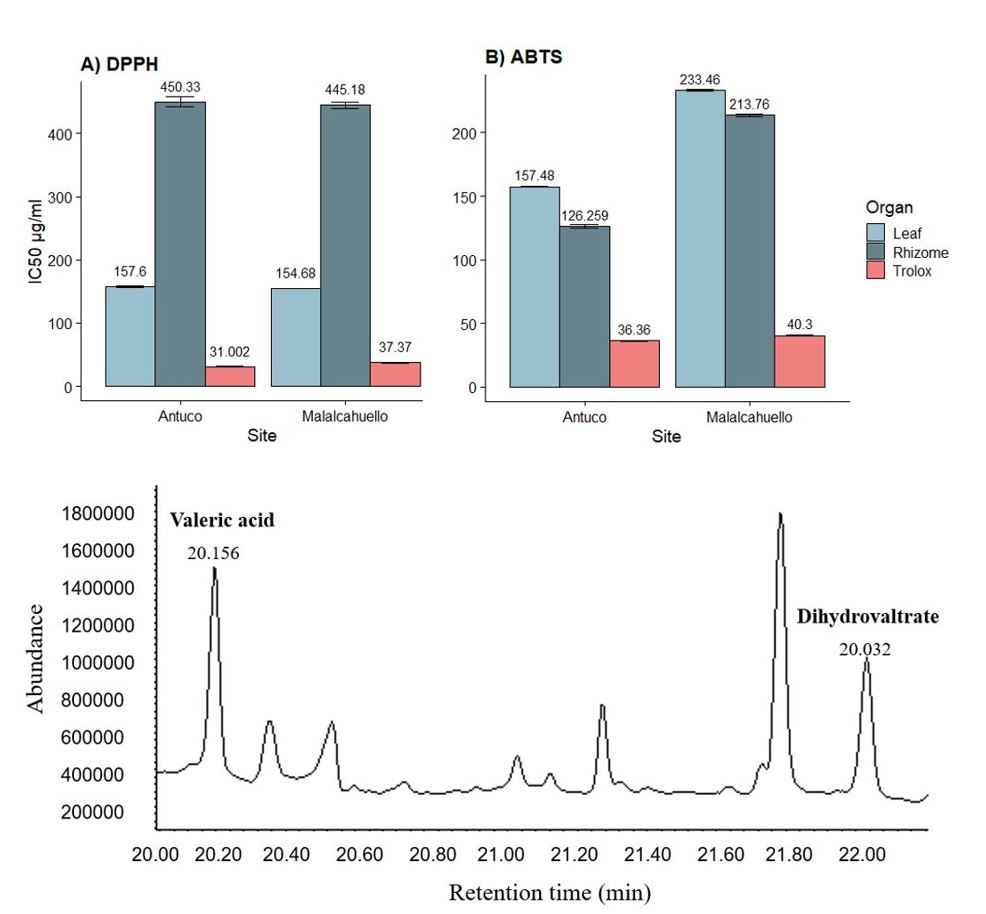
Valeriana carnosa SM (Caprifoliaceae), especie nativa de Chile, se distribuye desde la Región del Maule hasta Tierra del Fuego. Los rizomas y raíces se han utilizado para tratar diferentes enfermedades en forma de infusión, principalmente debido al amplio espectro de compuestos químicos con preocupación biológica. Esta investigación consistió en realizar una caracterización química y evaluación de la actividad antioxidante de V. carnosaen poblaciones naturales distribuidas en la zona centro-sur de Chile. La caracterización de los extractos se realizó mediante GC-MS, mostrando que los extractos de rizoma tanto del Parque Nacional Laguna del Laja como de la Reserva Nacional Malalcahuello mostraron un mayor porcentaje de sesquiterpenos, ácidos grasos y alcanos. Por otro lado, los extractos de hojas para el sitio Antuco presentaron mayor abundancia de alcanos y ácidos grasos y para Malalcahuello, alcanos y fitoesteroles. Se demostraron diferencias significativas en los extractos de rizoma según los valores de IC 50 (157,6 y 154,8 µg / ml) en ambos sitios, sin embargo, para los extractos de hojas, Antuco presentó una IC 50 mayor .(450,33 µg / ml). ABTS, mostró que Antuco presentó una mayor actividad para ambos extractos, y la misma tendencia se demostró en el contenido de polifenoles, evaluados por el método Folin-Ciocalteu. En conclusión, la distribución de la especie e, indirectamente, las condiciones del sitio se consideran relevantes en esta investigación, mostrando una incidencia directa sobre la actividad biológica y perfil químico de V. carnosa.
References
2. X. Yang, S. Wei, B. Liu, D.. Guo, B, Z, L. Feng, Y. Liu, F.A Tomás-Barberán, L. Luo, D. Huang, Hort. Res. 5, 1, (2018).
3. T. Hartmann. Phytochemistry. 68, 2831, (2007).
4. B.D. Moore, R.L. Andrew, C. Külheim, W.J. Foley. New Phytol. 201, 733. (2014).
5. N. Verma, S. Shukla. J Appl Res Med Aromat Plants. 2, 105, (2015).
6. S.K. Banerjee, C.G. Bonde, Res. J. Medicinal Plant. 5, 817, (2011).
7. L.L. Saldanha, P.M. Allard, A. Afzan, F. Pereira de Souza Rosa de Melo, L. Marcourt, E.F. Queiroz, W. Vilegas, C.M. Furlan, A.L. Dokkedeal, J.L. Wolfender. Molecules.25, 1, (2020).
8. T. Isah. Biol. Res. 52, 1, (2019).
9. I.D. Bhatt, P. Dauthal, S. Rawat, K.S. Gaira, A. Jugran, R.S. Rawal, U. Dhar. Sci. Hortic. 136, 61, (2012).
10. Y. Liu, P. Chen, M. Zhou, T. Wang, S. Fang, X. Shang, X. Fu. Molecules. 23,1, (2018.
11. F. Han, G.Q. Ma, M. Yang, L. Yan, W. Xiong, J.C. Shu, Z.D. Zhao, H.L. Xu. J Zhejiang Univ Sci B. 18, 79, (2017).
12. R. Rodriguez, C. Marticorena, D. Alarcón, C. Baeza, L. Cavieres, V.L. Finot, F. Nicol, A. Kiessling, M. Mihoc, A. Pauchard, E. Ruíz, P. Sanchez, A. Marticorena. Gayana Bot. 75, 1, (2018).
13. A. Kutschker. Gayana Bot. 68, 244, (2011).
14. H.G. Bach. Universidad de Buenos Aires. 162, (2015).
15. J. Guajardo, B. Gastaldi, S. González, N. Nagahama. Bol. Latinoam. Caribe plantas med.aromát. 17, 381, (2018).
16. S. Morales, A. Ladio. J Ethnopharmacol. 123, 397, (2009).
17. S. Morales, A.H. Ladio. Darwiniana. 50, 7, (2012).
18. O. Sermukhamedova, A. Ludwiczuk, J. Widelski, K. Glowniak, Z. Sakipova, L. Ibragimova, E. Poleszak, G. A. Cordell, K. Skalicka-Wozniak. Open Chem. 15, 75, (2017).
19. P. Morales, A.M. Carvalho, M.C. Sánchez-Mata, M. Cámara, M. Molina, I.C. Ferreira. Genet. Resour. Crop Evol. 59, 851, (2012).
20. R. Re, N. Pellegrini, A. Proteggente, A. Pannala, M. Yang, C. Rice-Evans. Free Radic. Biol. Med. 26, 1231, (1999).
21. S. Mongkolsilp, I. Pongbupakit, N. Sae-Lee, W. Sitthithaworn. J Pharm Sci. 9, 32, (2004).
22. S. Thusoo, S. Gupta, R. Sudan, J. Kour, S. Bhagat, R. Hussain, M. Bhagat. BioMed Res. Int. 2014, 1, (2014).
23. D. Huang, B. Ou, R.L. Prior. J. Agric. Food Chem. 53, 1841, (2005).
24. A. Floegel, D.O. Kim, S.J. Chung, S.I. Koo, O.K. Chun. J Food Compost Anal. 24, 1043, (2011).
25. N. Nagahama, B. Gastaldi, M. Clifford, M.M. Manifesto, R.H. Fortunato. AIMS Agric. Food. 6, 106, (2020).
26. S. Rawat, I.D. Bhatt, R.S. Rawal, S.K. Nandi. J. Food Biochem. 41, 1, (2017).
27. F. Karahan, C. Avsar, I. Ozyigit, I. Berber. Biotechnol. Biotechnol. Equip. 30, 797, (2016).
28. K.F. Khattak, T. Rahman. Pak J Pharm Sci. 28, 1671, (2015).
29. S.T. Chang, J.H. Wu, S.Y. Wang, P.L. Kang, N.S. Yang, L.F. Shyur. J. Agric. Food Chem. 49, 3420, (2001).
30. B. Shan, Y.Z. Cai, M. Sun, H. Corke. J. Agric. Food Chem. 53, 7749, (2005).
31. A. Wojdylo, J. Oszmianski, R. Czemerys. Food Chem. 1005, 940, (2007).
32. A.G. Pirbalouti, B.B. Ghahfarokhi, S.A.M. Ghahfarokhi, F. Malekpoor. Ind Crops Prod. 63, 147, (2015).
33. Z. Zargoosh, M. Ghavam, G. Bacchetta, A. Tavili. Sci. Rep. 9, 1, (2019).
34. P.J. Houghton. J. Pharm. Pharmacol. 51, 505, (1999).
35. J. Wang, J. Zhao, H. Liu, L. Zhou, Z. Liu, J. Wang… F. Yang. Molecules. 15, 6411, (2010).
36. M. Pavlovic, N. Kovacevic, O. Tzakou, M. Couladis. J. Essent. Oil Res. 16, 397, (2004).
37. A. Villar Del Fresno, M.A. Carretero. Farm. Prof. 15, 98, (2001).
38. N. Singh, A.P. Gupta, B. Sing, V.K. Kaul. Chromatographia. 63, 209, (2006).
39. J. Sánchez-Brunete. Universidad Complutense. 20, (2018).
40. J. Patočka, J. Kajl. J. Appl.Biomed. 8, 11, (2010).
41. R.S. Verma, R.C. Padilla, A. Chauhan. J. Essent. Oil-Bear. Plants. 16, 835, (2013).
42. F. Wang, Y. Zhung, S. Wu, Y. He, Z. Dai, S. Ma, B. Liu. Plos One. 12, 1, (2017).
43. K. Javidina, R. Miri, M. Kamalinejad, H. Khazraii. Flavour Frag. J. 21, 516, (2006).
44. O. Tzakou, M. Couladis, M. Pavlovix, M. Sokovic. J. Essent. Oil Res. 16, 500, (2004).
45. J.C. Tafolla-Arellano, A. González-León, M.E. Tiznado-Hernández, L. Zacarías-García, R. Báez-Sañudo. Rev. Fitotec. 36, 3, (2013).
46. H. Schaller. Prog. Lipid Res. 42, 163, (2003)
47. E.J. Dufourc. Plant Signal. Behav. 3, 133, (2008).
48. T. Griebel, J. Zeier. Plant J. 63, 254, (2010).